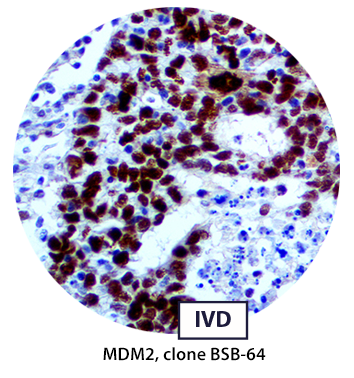
MDM2 est un régulateur négatif important du suppresseur de tumeur p53. La protéine MDM2 possède à la fois la fonction d’une ubiquitine ligase E3 qui reconnaît le domaine N-terminal de trans-activation (TAD) du suppresseur de tumeur p53, et celle d’un inhibiteur de l’activation de la transcription de p53. Déjà connue pour son rôle d’oncogène, il a été montré que la protéine MDM2 est surexprimée dans plusieurs tumeurs humaines et notamment dans les sarcomes des tissus mous, les ostéosarcomes, ainsi que les tumeurs du sein.
Les liposarcomes bien différenciés (WDLPS), les tumeurs atypiques lipomateuses (ALT-WDLPS) et les liposarcomes dédifférenciés (DDLPS) peuvent être difficiles à différencier des tumeurs adipeuses bénignes et des sarcomes faiblement différenciés. Ces tumeurs ont été caractérisées par une amplification des gènes MDM2 et CDK4 sur le chromosome 12q13-15 ainsi, qu’une surexpression de ces protéines. Leur détection par IHC peut ainsi être utilisée pour le diagnostic des WDLPS et des DDLPS.
Un marquage nucléaire fort et diffus constitue un bon modèle d’immunomarquage dans la plupart des cellules néoplasiques.
Les ostéosarcomes de bas grade peuvent être classés en deux sous-groupes principaux sur la base de la localisation par rapport au cortex osseux, à savoir l’ostéosarcome parostéal et l’ostéosarcome bas grade central. Leur apparence histologique est assez similaire, et caractérisée par un stroma à cellules fusiformes avec une densité faible à modérée et une anastomose des travées osseuses bien différenciée. MDM2 et CDK4 sont des marqueurs spécifiques et sensibles pour le diagnostic des ostéosarcomes de bas grade, les différenciant ainsi des lésions fibreuses bénignes et des lésions fibro-osseuses.
